Plaque pour "dry cell", quel materiel??
|
|
Classique |
|
Liste |
|
Arborescence |
♦
♦

Plaque pour "dry cell", quel materiel??
|
Pourquoi est il preferable d'utiliser l'inox 316 plutot qu'un autre ?
J'ai vu certain Dry Cell en titanium, sont ils meilleur que ceux en inox? Merci d'avance. Freddy |
Re: Plaque pour "dry cell", quel materiel??
|
le 316 ou 316L resiste bien mieux a la corrosion mais il né pas tré solide...
l'acier inoxydable 316 et 316L? le "L" signifie "Low carbon" (basse teneur en carbone). Le bas carbone permet d’éviter la formation de carbures (notamment de carbures de chrome, qui est un composé très stable mais qui n'empêche pas l'oxydation du fer). 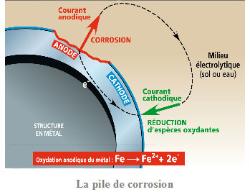 être classé dans la catégorie inoxydable, un acier doit contenir au moins 10,5% de chrome et moins de 1,2% de carbone. La corrosion des matériaux métalliques à température ambiante ou relativement peu élevée est essentiellement due à l'eau liquide venant à leur contact. La phase aqueuse peut être neutre, acide ou basique. La corrosion aqueuse est un processus électrochimique qui voit son origine dans le caractère de conduction électrique des deux phases en présence : conduction électronique dans la phase métallique et conduction ionique dans la phase aqueuse, appelée aussi électrolyte. Les réactions électrochimiques permettent les transferts de charge au niveau de l'interface entre le métal (électrode) et l'électrolyte. 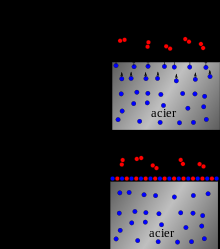 La vitesse de corrosion d'un métal est donc directement liée à l'intensité des réactions anodiques et cathodiques qui se déroulent à l'interface. Le flux d'électrons, qui est donc le courant de corrosion, est lié, par la loi de Faraday, à la quantité de métal oxydé. 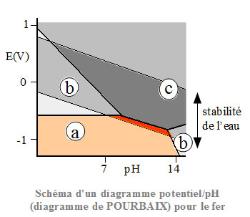 Diagramme de Pourbaix |
Re: Plaque pour "dry cell", quel materiel??
|
Re: Plaque pour "dry cell", quel materiel??
|
En réponse à ce message posté par WoLToR
Oui sa marche!
Sa tenue à la corrosion est exceptionnelle dans de nombreux milieux tels que l’eau de mer ou l’organisme humain. entre le titan et l inox vous avez infime difference, probleme de conductivité et de résistivité Titan 2.4 de conductivité et 41.7 de résistivité au métre inox 1.32 de conductivité et 76.0 de résistivité au métre L’alliage le plus couramment utilisé est le TiAl6V4 Le titane est un métal extrêmement oxydable. Dans la série des potentiels électrochimiques standards, il se place au voisinage de l’aluminium, entre le magnésium et le zinc. Il n’est donc pas un métal noble, son domaine de stabilité thermodynamique ne présente, en effet, aucune partie commune avec le domaine de stabilité thermodynamique de l’eau et est situé fortement au-dessous de ce dernier. L’une des causes de la résistance à la corrosion du titane est le développement d’une couche protectrice passivante de quelques fractions de micromètre, constituée majoritairement d’oxyde TiO2, mais il est reconnu qu’elle peut contenir d’autres variétés. Cette couche est intègre et très adhérente. En cas de rayure de la surface, l’oxyde se reforme spontanément en présence d’air ou d’eau. Il y a donc inaltérabilité du titane dans l’air, l’eau et l’eau de mer. De plus, cette couche est stable sur une large gamme de pH, de potentiel et de température. Des conditions très réductrices, ou des environnements très oxydants, ou encore la présence d’ions fluor (agent complexant), diminuent le caractère protecteur de cette couche d’oxyde ; les réactifs d’attaque pour relever les micrographies sont le plus souvent à base d’acide fluorhydrique. Lors d’une réaction par cet acide, il y a formation de cation titane (II) et (III). La réactivité des solutions acides peut néanmoins être réduite par l’adjonction d’agents oxydants et/ou d’ions lourds métalliques. L’acide chromique ou nitrique et les sels de fer, nickel, cuivre ou chrome sont alors d’excellents agents inhibiteurs. Cela explique pourquoi le titane peut être utilisé dans des procédés industriels et des environnements où les matériaux conventionnels se corroderaient. On peut bien entendu modifier les équilibres électrochimiques par adjonction d’éléments d’addition qui réduisent l’activité anodique du titane ; cela conduit à améliorer la tenue à la corrosion. Selon les desiderata de modifications, on ajoute des éléments spécifiques. Une liste non exhaustive de quelques adjuvants classiques est reprise ci-dessous : déplacement du potentiel de corrosion et renforcement du caractère de cathode : adjonction de platine, palladium ou rhodium ; accroissement de la stabilité thermodynamique et réduction de la propension à la dissolution anodique : adjonction de nickel, molybdène ou tungstène ; augmentation de la tendance à la passivation : adjonction de zirconium, tantale, chrome ou molybdène. Ces trois méthodes peuvent être combinées. Le titane est très peu sensible aux modes particuliers de corrosion tels que la corrosion caverneuse ou la corrosion par piqûre. Ces phénomènes ne sont observés qu’en cas d’utilisation dans un domaine proche d’une limite pratique de tenue à la corrosion générale. Les risques de corrosion sous contrainte apparaissent dans les conditions suivantes : à froid dans l’eau de mer (en présence d’entailles aiguës seulement) ; dans certains milieux particuliers tels que le méthanol anhydre ; à chaud, en présence de NaCl fondu. Les deux structures allotropiques se distinguent au niveau de la résistance à ce dernier type de corrosion ; le titane α y est fort sensible alors que le β quasiment pas. L'oxyde de titane TiO2 forme deux sortes d'empilement à l'état cristallin. Il forme de l'anatase ou du rutile. Ces deux substances ont la même formule chimique TiO2, mais l'arrangement des atomes dans l'espace n'est pas le même. le Ti réagissait avec l'oxydant H2O pour former TiO2 et H2. Mais j'ai un problème avec la courbe potentiel-pH correspondante : le domaine de Ti et de TiO2 ne sont pas collés. Je pensais que l'oxydation de Ti par l'eau aurait donné Ti2+ou Ti(OH)3 suivant le pH ? comment cela s'explique que la passivation de Ti donne du TiO2 ? (pour le diagramme E-pH, je précise que Ti est encore en-dessous de Ti2+ et Ti(OH)3) |
«
Retour à Le Forum Des Utilisateurs De Generateurs HHO
|
1 visualisation|%1 visualisations
| Free forum by Nabble | Edit this page |



