Électrolyse et électrolyte
|
|
Classique |
|
Liste |
|
Arborescence |
♦
♦

12



















12
|
Bonjour,
Voici un résumé du principe de l'électrolyse de l'eau 2H2O = 2H2(g) + O2 (g) L’eau pure contient très peu d’ions (H+ et OH-), ce qui explique qu’il s’agit d’une solution neutre (PH à 7) et qu’elle est peu conductrice. Pour un PH à 7, la quantité d’ions H+ de l’eau pure est 1,0 * 10-7 ml/L. La dissolution d’une base alcaline tel le NaOH dans l’eau pure forme des ions qui deviennent liquide. Ce sont ces ions qui transportent le courant électrique à travers l’eau. Le NaOH forme des cations Na+ et des anions OH- alors que le KOH forme des cations K+ et des anions OH-. Les cations Na+ du NaOH ou K+ du KOH n’entre pas en compétition avec les cations H+ de l’eau, ce qui en fait de très bon électrolyte pour produire de l’hydrogène. On dit du NaOH et du KOH qu’’ils sont de prédominances ionic(OH-). Il est préférable de prioriser l’utilisation du NaOH plutôt que le KOH puisque la conductivité électrique des cations Na+ est supérieur à celle des cations K+. En ajoutant de l’électrolyte tel du NaOH, la solution devient basic et son PH augmente. Plus le PH d’une solution est élevé, plus ça va nécessiter d’énergie pour produire de l’hydrogène. Avec un PH entre 0 et 7, à 23°C, ça prend théoriquement 1.23 volts (sans compter les diverses sources de résistances et les fuites de courant). Si le PH est > 7, à 23°C, ça va nécessiter plus de 1.23 volts. Toujours avec le PH, une solution avec un PH élevé (>7) aura une forte concentration d’hydroxyde OH- et une faible concentration d’hydronium H+. À l’inverse, une solution avec un PH bas aura une faible concentration d’hydroxyde OH- et une forte concentration d’hydronium H+. Pour ses raisons, il faut donc prioriser une solution avec le minimum de la concentration requise. Électrolyse de l’eau Chaque électrode (cathode «-» ou anode « + ») attire les ions de l’électrolyte de charge opposé. Les cations (Na+) se déplacent vers la cathode alors que les anions (OH-) se déplacent vers l'anode. La cathode fournit les électrons e- aux cations et l’anode absorbe (élimine) les électrons e- des anions. Il en résulte des anions et cations neutralisés et produisant les éléments désirés tel hydrogène, oxygène . 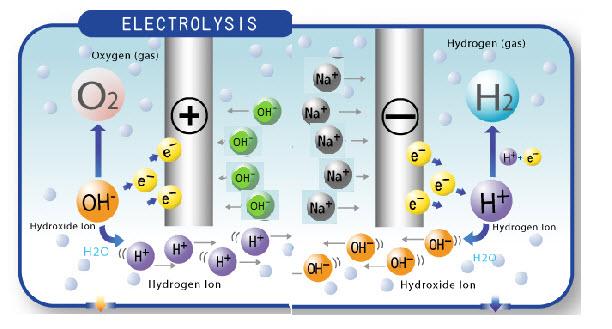 Dans le schéma ci-haut, les cations H+ et les anions OH- de la molécule d'eau de regroupe pour reformer un molécule d'eau.... S'il y a un chimiste parmi nous, j'aurais une question au sujet des cations Na+ et Anions OH- de l'électrolyte NaOH. Que deviennent-ils lorsqu'ils atteignent la cathode et l'anode ? Merci
Rémi
Quelque part où il fait bon vivre au Québec http://hho-rimouski.yolasite.com/ Un poêle à granulés sans électricité -> http://www.poeles-stamant.com/ |
Re: Électrolyse et électrolyte
|
Bonjour Remi.
Très intéressant. J'ai un peu mal à la tête mais ça va passer. - Donc ,si j'ai bien compris, c'est pour cette raison que comme certains l'on constaté, le débit de gaz augmente avec la concentration de l'électrolyte jusqu'à un certain moment ou la tendance commence à s'inverser ? - Peut tu nous confirmer que NAOH et KOH sont des catalyseurs et qu'ils ne sont donc pas consommés pendant l'électrolyse ? Sinon pour ce qui concerne la question je pense que tu auras probablement la réponse ici : http://forums.futura-sciences.com/chimie/ Merci pour ces infos. |
Re: Électrolyse et électrolyte
Tout à fait, plus le taux de l'électrolyte augmente, plus on augmente la quantité de cations Na+ et d'anions OH- et par conséquent, plus grande sera la circulation du courant ayant comme une plus forte production d'hydrogène et d'oxygène. Oui, le NaOH et le KOH sont des catalyseurs engendrant une solution basique. Mais je n'arrive pas à savoir que devienne les cations Na+ et anions OH- de l'électrolyte. Il ne doivent surement pas disparaitre sinon la concentration de NaOH aurait tendance à baisser rapidement et la production de gaz s'atténuerait .... C'est ma grosse interrogation ....
Rémi
Quelque part où il fait bon vivre au Québec http://hho-rimouski.yolasite.com/ Un poêle à granulés sans électricité -> http://www.poeles-stamant.com/ |
Re: Électrolyse et électrolyte
|
Re bonjour Remi.
Une question juste pour être sûr d'avoir bien compris. Donc plus on augmente la concentration de NAOH et plus on va produire de gaz, jusqu'à PH 7 et ensuite ça risque de produire l'effet inverse ? |
Re: Électrolyse et électrolyte
|
En réponse à ce message posté par Remi
Bonsoir,
Je ne suis pas chimiste mais pour moi une fois que les ions ont touchés les éléctrodes, il sont "foutus" si je puis dire. Car une fois qu'ils se sont chargés ou déchargés d'ions, les molécules deviennent stables et la il y a deux solutions : Soit la qualité de l'inox laisse a desirer et les molécules s'aglutinent sur les plaques, les rendants noirs, pouvant peut etre meme les percer, Soit il y a une bonne qualité d'inox et les molécules seront évacuer grace aux bulles créer par l'éléctrolyse, d'ou la necessité d'un bulleur pour éliminer ces molécules (ou d'un réservoir bulleur), mais de toute facon l'inox finira par percer avec le temps. Voilà ce que je pense, mais comme je l'ai dit plus haut je ne suis pas chimiste. Bonne nuit à vous. Cordialement. |
Re: Électrolyse et électrolyte
|
En réponse à ce message posté par educis
J'ignore pour le PH mais je sais que quand la concentration de NaOH atteint 20% (KOH à 25%), c'est effectivement l'effet inverse qui se produit et la production diminue. Attention cependant, plus on augmente le taux de l'électrolyte, moins le gaz est de qualité (ratio des atomes ortho et proto de la molécule d'hydrogène) et plus c'est dommageable pour les plaques de SS.
Rémi
Quelque part où il fait bon vivre au Québec http://hho-rimouski.yolasite.com/ Un poêle à granulés sans électricité -> http://www.poeles-stamant.com/ |
Re: Électrolyse et électrolyte
|
En réponse à ce message posté par Savi28
Savie, Ton énoncé tiens la route. C'est une explication logique. JE vais essayer d'aller rencontrer un chimiste et d'en avoir la confirmation. Merci
Rémi
Quelque part où il fait bon vivre au Québec http://hho-rimouski.yolasite.com/ Un poêle à granulés sans électricité -> http://www.poeles-stamant.com/ |
Re: Électrolyse et électrolyte
|
En réponse à ce message posté par Remi
bonjour Remi
je suis venu à m"intéresser au HHO par des chemins biens détournés, c'était principalement l'électrolyse et la possibilité de "démétaliser " l'argenterie, mais aussi le chauffage individuel avec un courant alternatif. pour la métalisation (chromage, placage d'argent ou d'or)les industriels utilisent des solutions acides (acide sulfurique par ex)j'ai laissé tomber car les divers produits utilisés sont trop dangereux pour la santé et la nature et ça ne correspond pas à mon état d'esprit j'ai été pendant 25 ans fabricant de fromages fondus, où là on utilise des citrates et des phosphates pour obtenir des liaisons différentes des molécules selon le résultat recherché, quand je parlais de ph neutre c'était plutot 5.6 à 6 , au de la c'était alcalin je vis dans une région où l'eau est très calcaire, en fait si j'utilise l'eau du robinet, j'ai de très bons résultats mais je dégrade très vite mon électrode + , même le 316l, aussi je compense et bloque cette dégradation en acidifiant légèrement l'eau, j'ai ainsi une production de HHO qui me convient, mais mon électrolyte ne dure que 2/3 jours après il ne donne plus rien mon interrogation du moment : faut'il utiliser de l'eau distillée, de l'eau de pluie, de l'eau déminéralisée, comme base?et quelle est la composition exacte de ces trois eau? il me semble que c'est cette base de départ qui est importante |
Re: Électrolyse et électrolyte
Sur les forums Américains, je me suis fait un ami qui s'y connait royalement en HHO. Il travaille a améliorer le produit depuis plus de 5 ans et il est sur le point d'obtenir son homologation Californienne. Son produit sera breveté d'ici quelque jours. Pour lui, la règle d'or, c'est d'utiliser de l'eau distillé à la vapeur. SI on parle d'une base, il faut partir avec une base qui ne contient aucun autre produit.
Rémi
Quelque part où il fait bon vivre au Québec http://hho-rimouski.yolasite.com/ Un poêle à granulés sans électricité -> http://www.poeles-stamant.com/ |
Re: Électrolyse et électrolyte
|
bonjour Remi
là je suis tout à fait d'accord avec ce californien, mais ça signifie qu'il y a une dépense d'énergie supplémentaire à prendre en compte puisqu'il faut chauffer l'eau , si tu peux nous envoyer un lien avec son système c'est simpa |
Re: Électrolyse et électrolyte
|
oups ! sympa!
depuis que je milite pour un effort sur l'orthographe, je dois faire attention! |
Re: Électrolyse et électrolyte
|
En réponse à ce message posté par alain
Actuellement, il termine la dernière phase des essais (c'est à dire qu'il trouve les bonnes recettes pour les voiture les plus populaire). Il travaille sur une flotte d'environ 50 véhicules au USA (climat chaud) et au CANADA (climat froid). Donc, encore aucun site web pour la disponibilité des produits. Au plaisir
Rémi
Quelque part où il fait bon vivre au Québec http://hho-rimouski.yolasite.com/ Un poêle à granulés sans électricité -> http://www.poeles-stamant.com/ |
Re: Électrolyse et électrolyte
|
En réponse à ce message posté par Remi
Bonjour, je vous propose quelques précisions :
Faux dirais-je, car la propriété d'une solution à laisser passer la courant (la conductivité) dépend de la conductivité molaire ionique de tous les ions présents dans la solution. Cette conductivité molaire ionique est propre à chaque type d'ion. Elle est de 7,35mS.m2.mol-1 pour K+ (le potassium) Et de seulement 5,01mS.m2.mol-1 pour le Na+ (le sodium). Concernant la conductivité électrique, c'est donc une solution de KOH qui sera la meilleure. NaOH et KOH en solution ne sont pas des catalyseurs car ils ne participent pas aux réactions chimiques. Un catalyseur est une espèce qui participe à une double réaction chimique rapide. La première réaction chimique transforme le catalyseur en un produit, et ce produit retrouve son état d'origine suite à la deuxième réaction chimique. Ce qui n'est pas la cas des ions Na+ et K+. Une fois en solution les ions Na+ et K+ sont des ions spectateurs. Ils ne participent pas à la réaction. Ils sont juste présents, et assure le neutralité électrique de la solutions avec leurs charges positifs. En réalité, les équations sont les suivantes : A la cathode (-) l'eau est réduite en H2 selon l'equ : H2O + 2e- = H2 + 2HO- A l'anode (+) l'ion HO- est oxydé en H2O selon l'equ : 4HO- = O2 + 2 H2O + 4e- En combinant les deux demi équations d'oxydo-réduction cela donne : 4H2O + 4HO- -------> 2H2 + O2 + 2H2O + 4HO- La réaction est auto-alimentée grâce aux ions HO-. Et on peux voir que K+ ou Na+ ne participe aucunement à la réaction. Néanmoins, il peut arriver que K+ ou Na+ se chope un électron, ce qui donnera K+ e- = K (solide) Na+ + é- = Na (solide) Nous aurons alors un léger dépôt de sodium ou de potassium le long de notre ou nos plaque à polarité négative. Je ne peux cependant rien affirmer concernant la fréquence de ce phénomène.  |
Re: Électrolyse et électrolyte
|
Salut,
Juste un mot concernant ces derniers commentaires : Néanmoins, il peut arriver que K+ ou Na+ se chope un électron, ce qui donnera K+ e- = K (solide) Na+ + é- = Na (solide) Nous aurons alors un léger dépôt de sodium ou de potassium le long de notre ou nos plaque à polarité négative. Je ne peux cependant rien affirmer concernant la fréquence de ce phénomène. ... il y a effectivement création du métal, comme ce serait le cas pour cuivrer un objet, à partir d'une solution de sulfate de cuivre (bleue). Sauf que là le métal Na ou K sont 2 métaux qui réagissent violamment avec l'eau. Et la réaction est simple : Na + H20 = Na OH = 1/2 H² ... retour à la case départ, la soude est cassés par électrolyse, puis recomposée au moment de l'attaque du Na par l'eau, avec dégagement de H² Si la cathode était du mercure, alors là ce serait différent ... Na serait dissout (amalgame) avec le mercure, donc pas de dégagement de H². Le dégagement de H² se ferait si on fait passer le mercure dans de l'eau, alors on retrouverait la soude NaOH et 1/2H². Cette réaction est exploitée pour la fabrication de chlore et de soude à partir de Na Cl (le sel de table). On électrolyse l'eau salée sur cathode de mercure. On a le 1/2Cl² qui se dégage au +, et le sodium amalgamé au - ... En faisant passer l'amalgame dans l'eau on régénere le mercure, et on génére la soude NaOH avec production de 1/2 H². Pour continuer cette chimie "amusante" on a du H², du Cl², on fait bruler le H² dans le chlore (puissant oxydant) et on obtient HCl, l'acide chlorydrique. La boucle est bouclée .. mais on est un peu loin du sujet. A+ MBHHO |
Re: Électrolyse et électrolyte
|
Bonjour Messieurs Ashlia et MBHHO,
En considérant que vos affirmations précédentes, j'en conclu que vous avez de très très bonnes connaissances en chimie. À cet effet, je prend une chance de vous poser la question suivante .... Auriez-vous une solution simple, économique et efficace pour séparer l'hydrogène et l'oxygène afin d'être en mesure de ne conserver que l'hydrogène et de pouvoir rejeter l'oxygène dans l'air ? Merci
Rémi
Quelque part où il fait bon vivre au Québec http://hho-rimouski.yolasite.com/ Un poêle à granulés sans électricité -> http://www.poeles-stamant.com/ |
Re: Électrolyse et électrolyte
|
bonjour,
Remi la question rejoint en fait un commentaire (mais aussi question) sur le sujet gene 120V, où je demandait pourquoi pas en alternatif .. je pensais a des gene fixes alimentait par le réseau. Le - donne H², le + O². comme on ne met pas de séparateur poreux entre les plaques, effectivement les 2 gaz se mélangent, et donc aussi bien faire l'électrolyse en alternatif. Pour votre question, la réponse c'est membrane poreuse, qui va laisser passer les ions, et pas les gaz. Par contre c'est pas ma partie, faudrait regarder coté des piles à combustible qui ont le même probléme .. mais à l'envers. http://fr.wikipedia.org/wiki/Pile_%C3%A0_combustible_%C3%A0_membrane_d%27%C3%A9change_de_protons les membranes sont largement faites en polymére dit : Nafion® membrane .. à chercher sur le WEB Voila, j'en sais pas plus ... mais j'entrevoie un schéma sans membrane dans la droite ligne des experiences de chimie d'école avec 2 éprouvettes renversées sur une cuve à eau acidulée (ici Na OH) ... à évaluer. BMHHO |
Re: Électrolyse et électrolyte
|
En réponse à ce message posté par Remi
Bonjour Remi Pourquoi vouloir supprimer l'O2 ? Serais-ce pour ne pas avoir à "tromper" les sondes de la voiture par exemple ? Pour ma part, je vois peut être un moyen, mais pas avec la configuration dry cell à plaques. J'opterais plutôt pour des tuyaux. Voici ce que j'imagine : 
Je prendrais la configuration de base de l'électrolyse avec deux electrodes. 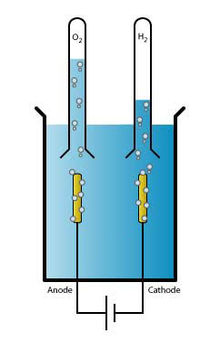 Chaque électrode serait composée d'une série de tubes concentriques imbriqués les uns dans les autres comme des poupées russes (nombre et taille à définir). Il serait aussi possible de multiplier ces tuyaux concentriques. Par exemple 3 éléments par électrode pour une plus grosse production de gaz...... Je placerais au dessus des deux électrodes ainsi formées deux entonnoirs connectés à des tuyaux plastiques pour emmener les gaz là où on veut qu'ils aillent. ------> celui de la cathode (H2) vers le moteur ------> celui de l'anode (O2) vers l'extérieur (où pourquoi pas vers l'habitacle du véhicule pour ceux qui ont besoin de se détendre un petit coup !  ) )
Tout ceci serait immergé dans un caisson étanche avec deux trous pour les deux tuyaux de sortie. Il faudrait en outre ajouter au niveau du couvercle (dans tous les cas au dessus des entonnoirs) un troisième tuyau plastique au milieu des deux autres pour jouer le rôle de "VMC" et sortir les gaz qui auraient "ratés" les entonnoirs. Ce troisième tuyau pourrait être évité si chaque électrode était séparée par une membrane poreuse qui laisse passer les ions mais pas les gaz...... Je ne sais pas si cela existe ? Puisque la membrane de la pile à combustible laisse passer les cations (les ions positifs), mais je ne crois pas qu'elle laisse passer les anions (comme l'ion HO-). A chercher........ Voilà ce que je ferais au vu des mes quelques connaissances théoriques.......et cela ne me semble pas trop couteux....... |
Re: Électrolyse et électrolyte
|
J'ai déjà vu un brevet USA sur lequel les atomes d'oxygène étaient attirées par un aimant.
Selon ce que j'en ai compris, les atomes d'oxygène seraient attirées par les aimants alors que les atomes d'hydrogènes seraient repoussées par les aimants. Cette séparation se faisait dans le bas du bulleur Malheureusement, je n'y avais pas porté une grande attention et je n'ai pas marqué cette page dans mes favoris 
Rémi
Quelque part où il fait bon vivre au Québec http://hho-rimouski.yolasite.com/ Un poêle à granulés sans électricité -> http://www.poeles-stamant.com/ |
Re: Électrolyse et électrolyte
|
En réponse à ce message posté par mbhho
Bonjour mbhho.
"pourquoi pas en alternatif" Je suis surpris que personne n'ai répondu ! L''électrolyse fonctionne seulement en courant continu. c'est pour cela que tous les générateurs en 110 V ou 220 V utilisent un redresseur. J'espère avoir compris la question et ne pas avoir répondu hors sujet ? Bon HHO |
Re: Électrolyse et électrolyte
Bonjour, merci educis. Tu n'es pas hors sujet, mais ta réponse .. hum... Alors voilà je vais développer, ma pensée. Un "embryon" de réponse, pourrait être relié à la tension qui n’est pas constante en alternatif, et à la tension optimale pour une cellule souvent prise à 2 V dans ce forum. Soyons clair, on prend un géné, avec le nombre de plaques qui vont bien, il est alimenté en 12V continu (du vrai continu issue d’une batterie) . La connection du + et - (polarité), n'a pas d'importance si on met le + à gauche ou à droite .. .dit autrement tu connectes d'une façon : Ça marche, tu inverses la polarité Ça marche aussi. Pourquoi, tout simplement parce que H2 et O2 sont mélangés et que ce soit les plaques de gauche ou de droite qui donne le H2 .. n'a aucune importance. Donc si maintenant tu inverses la tension 50 fois par seconde (alternatif) ça marche aussi. Là il n’y a pas de discussion possible. Par contre l’alternatif, c’est pas tout à fait ça (ci-dessus dans l’exemple on a un signal CARRE qui s’inverse). Pour l’alternatif on détermine une tension efficace = U max / racine (2) = U max / 1.414, et la tension instantanée varie sinusoïdalement en fonction du temps. Si on a par exemple U eff = 2 V (tension optimale de cellule) alors U max = 2.8 V .. valeur jugée un peu trop forte et qui augmente les pertes (chauffage). La tension sur une alternance varie donc de –V à +V. entre 0 et environ 1.5 V .. normalement pas de courant (partie rouge) , puis jusqu’à 2.5V .. tension optimale, puis de 2.5 à 2,8V trop fort (partie violette). Le résultat c’est qu’il faut dimensionner à U max = environ 2.5 V par cellule pour pas trop chauffer, et que donc la tension d’alim par cellule en alternatif serait 2.5/1.141 = 1.8 V, qui serait un bon compromis. Par contre on n’exploite pas toute la puissance possible, car pendant environ 1/3 du temps la cellule ne débite pas. Est-ce grave ? 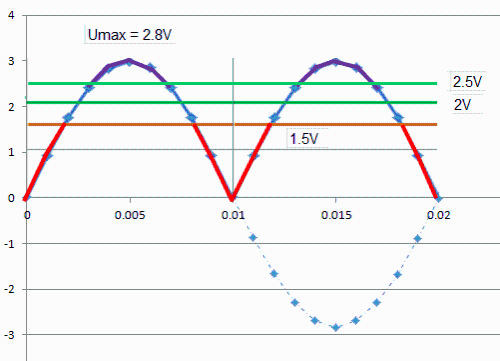 Depuis ma question j'ai appris ... en particulier (je le savais car j'ai fait de l'électrochimie à l'IUT .. mais c'est loin), il y a un potentiel (d'oxydo réduction ?).. ça veut dire qu’il faut appliquer une tension mini aux électrodes pour avoir un courant. Ça dépend des métaux et électrolytes. Quelques liens, mais bon c’est juste pour illustrer le sujet. http://gyci.educanet2.ch/doc.campiche/Electrochimie/Illustrations/Tpredox.htmlhttp://www.afh2.org/uploads/memento/Fiche%203.2.1%20electrolyse%20rev%20mai%202011%20Th.A.pdf J’ai aussi trouvé ça : … la décomposition de l’eau demande un apport d’énergie électrique, dépendant essentiellement de l’enthalpie et de l’entropie de réaction. Le potentiel théorique de la décomposition est de 1.481 V à 298 K. Les valeurs classiques des potentiels de cellules industrielles sont de l’ordre de 1.7 à 2.1 V, ce qui correspond à des rendements d’électrolyse de 70 à 85 % (en se rapportant au PCS de 3,55 kWh/Nm3). La consommation électrique des électrolyseurs industriels (auxiliaires compris) est généralement de 4 à 5 kWh/Nm3. A noter qu’il convient d’éliminer en permanence la chaleur dégagée liée aux irréversibilités. Dans le forum on admet en général 2 v par cellule. Si on regarde le schéma de l’alim du post (Rémi), on voit un condensateur et 160 V (pour alim 120V0, oui 160 c’est à peu près 120 x 1.141. Sauf que la capa de 2000 micro est bien trop faible par rapport au courant, il faudrait au moins 10 000 ( 20 000 microfarads) pour lisser correctement. Dans ce cas on travaille à presque Umax… à ce moment il pour rester à 2 V par cellule faut réduire le 120 V à 85 V. On voit donc bien qu’on a intérêt à travailler en continu PUR, et à hacher pour réduire la puissance, mais à tension constante. Et donc il faut de l’électronique pour faire mieux et donc du continu. Je pense aussi sérieusement qu’en alternatif ça fonctionne, mais pas optimisé. Mais j’ai pas de géné pour essayer. Dites moi ce que vous en pensez !! Bon WE. MBHHO |
«
Retour à Le Forum Des Utilisateurs De Generateurs HHO
|
1 visualisation|%1 visualisations
| Free forum by Nabble | Edit this page |
